2022年 | プレスリリース・研究成果
シグナル伝達の「偏り」を生み出すリン酸化機構の解明 〜副作用を切り分けたGPCR作動薬の開発に貢献〜
【本学研究者情報】
〇大学院薬学研究科 分子細胞生化学分野 准教授 井上飛鳥
研究室ウェブサイト
【発表のポイント】
- 薬剤の主要な作用標的であるGタンパク質共役型受容体(GPCR、注1)の機能を調節する因子のGPCRキナーゼ(GRK、注2)について、その活性制御機構を明らかにしました。
- 降圧薬の標的として知られる1型アンジオテンシンII受容体(AT1受容体、注3)に関して、薬理作用の異なる作動薬が、別々のGRK選択性とβアレスチン(注4)機能を誘導することを見出しました。
- 本研究は、GPCRに作用する薬剤について、副作用が少なく安全性の高い創薬開発戦略を提示します。
【概要】
細胞膜に存在するGPCRと呼ばれるタンパク質センサーは、薬剤の主要な標的として知られています。通常のGPCR作動薬は、シグナル伝達因子である三量体Gタンパク質(以下Gタンパク質、注5)とβアレスチンの双方を作動させます。一方、特定のシグナル因子の機能のみを誘導する「バイアス型作動薬(注6)」は、副作用を低減させた理想的な薬剤になると期待されます。このような薬理作用のバランスは、薬剤が結合したGPCRの「かたち」そのものに大きく依存しているとこれまで考えられてきました。
今回、東北大学大学院薬学研究科の川上耕季研究員・井上飛鳥准教授らのグループは、理化学研究所開拓研究本部の柳川正隆研究員・佐甲靖志主任研究員らのグループとの共同研究により、βアレスチンの機能を制御する主要な因子であるGPCRキナーゼ(GRK)に着目した解析を実施し、GRKがGタンパク質の一種であるGqにより機能制御される新たな分子機構を解明しました。本研究成果を通じて、Gタンパク質とβアレスチンによる2つのシグナルバランスは、細胞膜に存在するGPCRの「かたち」だけでなく、細胞内に存在するGタンパク質の活性レベルがGPCRとGRKの「居場所」を変えることでβアレスチンの機能を調節するという、シグナルバランス制御機構の新たな概念を提唱しました。
本研究の成果は、日本時間1月25日に科学雑誌Nature Communications誌の電子版に掲載されました。
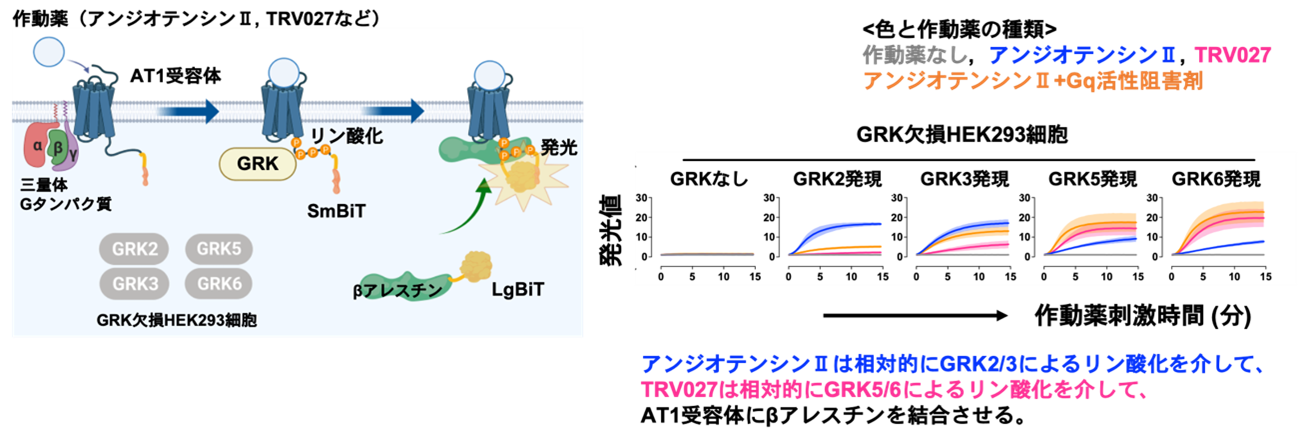
図1 AT1受容体をリン酸化するGRK解析法の構築と作動薬間での関与するGRKの評価 (左図)始めにヒト培養細胞株のHEK293細胞に発現する4種類のGRKサブタイプ(GRK2、GRK3、GRK5、GRK6)をゲノム編集技術CRISPR/Cas9法により遺伝子欠失させたGRK欠損細胞を作製した。本作製細胞に対して、1種類のGRKサブタイプを遺伝子導入(プラスミドDNAトランスフェクション)により発現させることで、個々のGRKサブタイプを個別に評価できる。この際、AT1受容体とβアレスチンにSmBiT断片とLgBiT断片をそれぞれ融合させた改変体を同時発現させることで、作動薬を加えた際にAT1受容体にβアレスチンが結合する過程を発光により検出可能となる。この技術により、どのGRKサブタイプがAT1受容体のリン酸化を介してβアレスチン結合を誘導するか、その評価手法を確立した。 (右図)内在性リガンドであるアンジオテンシンII刺激(青)と、バイアス型作動薬の一つであるTRV027刺激(マゼンタ)、Gq阻害剤を前処置+アンジオテンシンII刺激(オレンジ)の3条件でβアレスチン結合のAT1受容体への結合を測定した。その結果、アンジオテンシンII刺激時には、相対的にGRK2やGRK3を介しAT1受容体にβアレスチンが結合する一方で、TRV027刺激時では、相対的にGRK5やGRK6を介した作用が強いことがわかった。興味深いことに、Gq阻害剤存在下のアンジオテンシンII刺激時では、TRV027と同様のGRK選択性(GRK5やGRK6が相対的に強い)が生じた。これまではGPCRの構造に応じて結合するGRKサブタイプが変わると考えられてきたが、Gタンパク質のシグナル活性がGRKサブタイプの選択性に重要であることが初めて明らかとなった。
【用語解説】
(注1)Gタンパク質共役(きょうやく)型受容体(GPCR)
7回細胞膜を貫通する特徴的な構造を有する細胞膜受容体の一種である。ヒトにおいては約800種類存在しており、ホルモンなどの多様な細胞外の物質(リガンド)が結合することで、活性型へと構造変化をして、細胞内のシグナル因子と結合することで情報伝達を誘導する。
(注2)GPCRキナーゼ(GRK)
細胞質に存在し、活性型構造のGPCRに結合して、そのセリン・スレオニン残基をリン酸化する酵素である。4種類のGRKサブタイプ(GRK2、GRK3、GRK5、GRK6)が全身に広く発現しており、これらがGPCRのセリン・スレオニン残基に対して様々なパターンでリン酸基を付与すると想定されている。
(注3)1型アンジオテンシンII受容体(AT1受容体)
アンジオテンシンIIを認識するGPCR。アンジオテンシンIIが結合するとGqタンパク質を介して血圧上昇を誘導する一方で、βアレスチンを介して心臓の収縮を促進する。
(注4)βアレスチン
リン酸化GPCRに結合する細胞質の多機能タンパク質。三量体Gタンパク質と競合することでGタンパク質シグナルに拮抗する役割があるほか、GPCRのエンドサイトーシスやシグナル因子の足場としても機能する。
(注5)三量体Gタンパク質
Gα, Gβ, Gγの3つのサブユニットからなるタンパク質複合体であり、作動薬が結合したGPCRと結合すると構造変化を受け、GTP結合型GαとGβγに解離する。
(注6)バイアス型作動薬
基準となる作動薬(通常は内因性リガンド)と比べて、特定のシグナルに偏り(バイアス)を持って活性化する作動薬。主作用に関連するシグナルを強く誘導する一方で、望まない副作用に関連するシグナルを誘導しないバイアス型作動薬は、より安全性の高い薬となることが期待される。
問い合わせ先
【研究内容に関すること】
東北大学大学院薬学研究科
准教授 井上飛鳥
Tel: 022-795-6861
E-mail: iaska*tohoku.ac.jp
(*を@に置き換えてください)
【報道に関すること】
東北大学大学院薬学研究科総務係
Tel: 022-795-6801
E-mail: ph-som*grp.tohoku.ac.jp
(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
