2019年 | プレスリリース・研究成果
痛覚制御や血圧制御、薬物依存等に関与する受容体膜タンパク質、ニューロテンシン受容体によるGタンパク質活性化機構の解明
【発表のポイント】
- 多様な生理機能に関与する受容体膜タンパク質ニューロテンシン受容体(NTSR1)とGタンパク質の複合体構造を解明した。
- 2つのNTSR1-Gタンパク質複合体の構造から、NTSR1がGタンパク質を活性化する際に起こす構造変化を明らかにし、今まで報告されていなかった中間体構造を特定した。
- NTSR1は痛覚、血圧制御、薬物依存などさまざまな生理現象に関与するため、今回の構造情報は副作用を軽減させた鎮痛剤や降圧剤、薬剤依存治療薬の開発等に繋がることが期待される。
【発表概要】
ニューロテンシン受容体(NTSR1)(注1)は、主にヒトの脳内や消化管で発現しており、血圧、体温、食欲、痛覚といった多様な生理機能の制御に加え、薬物依存やがん細胞の増殖などへの関与も報告されているGタンパク質共役型受容体(GPCR)(注2)です。今回、東京大学大学院総合文化研究科の加藤英明准教授とスタンフォード大学医学部分子細胞生理学科のBrian Kobilka教授らは、東北大学大学院薬学系研究科の井上飛鳥准教授のグループ、スタンフォード大学医学部分子細胞生理学科のRon Dror教授、Georgios Skiniotis教授のグループなどとの共同研究のもと、NTSR1とGタンパク質(注3)との複合体構造を、クライオ電子顕微鏡(注4)を用いた単粒子解析法(注5)により、完全活性化状態と中間体状態の2状態で決定することに成功しました。さらに、立体構造をもとにした分子動力学シミュレーション(注6)や変異体解析(注7)により、NTSR1によるGタンパク質活性化の分子機構の一端を明らかにしました。今回のNTSR1-Gタンパク質複合体の構造情報は、GPCRによるGタンパク質の活性化機構に対する理解を大きく推し進めただけではなく、NTSR1を標的とする薬剤開発の基礎となる情報を提供し、副作用を軽減させた鎮痛剤や降圧剤、薬剤依存治療薬の開発等に貢献することが期待されます。
【用語解説】
注1:ニューロテンシン受容体
ニューロテンシン(注8)と呼ばれる13アミノ酸のペプチドによって活性化される膜受容体タンパク質であり、1型、2型、3型が存在している。そのうち、1型(NTSR1)と2型(NTSR2)はGタンパク質共役受容体(GPCR)(注2)に分類され、特にNTSR1は体内の血圧や体温、食欲や痛覚の制御などさまざまな生理現象に関与することから着目されている。元々は1990年に京都大学中西重忠教授らのグループにより発見された。
注2:Gタンパク質共役型受容体 (GPCR)
細胞膜上に存在する受容体タンパク質の1ファミリー。光や匂い分子、ホルモンや情報伝達物質などを受容すると、その立体構造を変化させ、Gタンパク質(注3)と呼ばれる別のタンパク質を活性化する。活性化されたGタンパク質は細胞内のさまざまなシグナル伝達経路を活性化させ、細胞内へと情報を伝える。ヒトでは800種を超える数のGタンパク質共役型受容体が報告されており、殆どあらゆる生理現象に関与している。そのため、薬剤標的の候補としても注目されており、実際市販の薬剤の約30%はこのGタンパク質共役型受容体を標的としている。
注3:Gタンパク質
グアニンヌクレオチド結合タンパク質の略称であり、結合したGTPをGDPに加水分解する働きを持つ。細胞内シグナル伝達に関与するタンパク質であり、大きく3量体Gタンパク質と低分子量Gタンパク質に分類される。特に3量体Gタンパク質はGs, Gi/o, Gq/11, G12/13 の4ファミリーに細分され、それぞれ異なるシグナル経路を活性化する。
注4:クライオ電子顕微鏡
低温に冷却したタンパク質試料に対して電子線を照射し、試料観察を行う方法。タンパク質の立体構造を決定する方法として近年目覚ましい技術革新を遂げており、2017年には、その開発に貢献したイギリス、アメリカ、スイスの研究者三名(Richard Henderson, Joachim Frank, Jacques Dubochet)にノーベル化学賞が贈られた。
注5:単粒子解析法
タンパク質の立体構造を決定する方法のひとつ。高純度の精製タンパク質を凍結し、クライオ電子顕微鏡(注4)を用いて、さまざまな角度から見たタンパク質1分子ごとの画像を大量に収集する。その後、計算機を用いることで、得られた大量の画像から元のタンパク質の立体構造を再構成する。
注6:分子動力学シミュレーション
タンパク質の機能を解析する上で幅広く用いられる手法の一つ。計算機の中で、タンパク質や周辺の脂質分子、水分子の原子間に働く力を計算し、ニュートン方程式を繰り返し解くことによって、分子の時間発展を追跡する。
注7:変異体解析
タンパク質の機能を解析する上で幅広く用いられる手法の一つ。タンパク質の機能に重要と考えられるアミノ酸残基について、そのアミノ酸残基を別のアミノ酸残基に置換した変異体タンパク質のプラスミドを用意し、その変異体タンパク質の機能を測定、評価することによって当該アミノ酸残基のタンパク質機能における寄与を推定する。本研究の場合は、NTSR1とGタンパク質にそれぞれ発光タンパク質であるルシフェラーゼのフラグメントを融合させ、NTSR1によるGタンパク質の活性化にともなう、Gタンパク質の乖離反応を発光強度の変化として測定した。
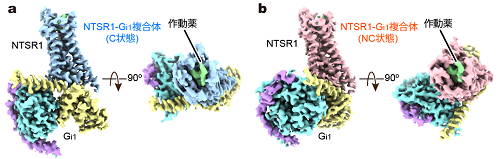
図1 NTSR1-Gi1複合体の立体構造
(a)C状態。(b)NC状態。
問い合わせ先
(研究内容に関すること)
東北大学大学院薬学研究科 分子細胞生化学分野
准教授 井上飛鳥
TEL:022-795-6861 FAX:022-795-6859
E-mail:iaska*m.tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院薬学研究科 総務係
Tel:022-795-6801 Fax:022-795-6805
E-mail:ph-som*grp.tohoku.ac.jp (*を@に置き換えてください)