2021年 | プレスリリース・研究成果
タンパク質の液-液相分離を制御するペプチド設計法を開発 ―神経変性疾患などの創薬に期待―
【本学研究者情報】
〇本学代表者所属・職・氏名:多元物質科学研究所・准教授・鎌形 清人
研究室ウェブサイト
【発表のポイント】
- タンパク質の液-液相分離を制御するペプチド設計法を考案
- 神経変性疾患関連タンパク質FUSの液-液相分離や固体状の凝集体形成の制御に成功
【概要】
認知症やアルツハイマー病などの神経変性疾患には、液-液相分離する「相分離タンパク質」の関与が明らかとなってきました。液-液相分離とは、タンパク質が低い濃度で分散している液相中に、タンパク質の密集した液相が形成される現象です。タンパク質が一時的に密集することで、高効率な化学反応が可能となりますが、同時に、疾患の原因となる不溶性の凝集体が形成されるリスクがあります。東北大学多元物質科学研究所の鎌形清人准教授、東北大学薬学研究科の川畑伊知郎准教授、福永浩司教授、富山大学学術研究部薬学・和漢系の池田恵介准教授、および産業技術総合研究所人工知能研究センターの亀田倫史主任研究員らの研究グループは、相分離タンパク質を制御するペプチドの効率的な探索法として、液-液相分離を制御できるアミノ酸の探索を行い、効果の出たアミノ酸を含むペプチドを設計する方法を考案しました。この方法により、神経変性疾患に関与するタンパク質FUSの液-液相分離や固体状の凝集体形成の制御にも成功しました。今後、疾患に関与する相分離タンパク質を標的とした創薬への応用が期待されます。
本研究成果は、2021年3月23日(英国夏時間)に英国科学誌Scientific Reports(オンライン版)に掲載されました。また、本研究は、科学研究費助成事業、および産総研-東北大マッチング事業の支援を受けて、実施されました。
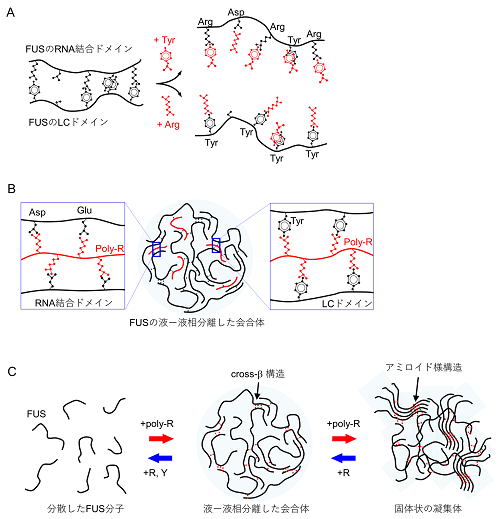
図. A)アルギニンとチロシンによるFUSの液-液相分離の抑制。FUSのLCドメインとRNA結合ドメインとの結合により、液-液相分離した会合体が形成されます(左図)。アルギニン(Arg)とチロシン(Tyr)は、FUSのLCドメインとRNA結合ドメインとの結合を阻害することで、FUSの液-液相分離を抑制します(右図)。B)ポリアルギニン(poly-R)は、FUSのLCドメインやRNA結合ドメインに結合し、FUSの液-液相分離を促進します。C)添加剤によるFUSの相分離の制御。RとYは、それぞれアルギニンとチロシンを表している。原著論文の図より転載しました。
問い合わせ先
(研究に関すること)
東北大学多元物質科学研究所
准教授 鎌形 清人(かまがた きよと)
電話: 022-217-5843
E-mail:kiyoto.kamagata.e8*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学多元物質科学研究所 広報情報室
電話: 022-217-5198
E-mail:press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
