2022年 | プレスリリース・研究成果
筋萎縮性側索硬化症(ALS)の発症機構の一端を解明 -タンパク質の高密度な凝縮構造が鍵-
【本学研究者情報】
〇多元物質科学研究所 教授 米倉功治
研究室ウェブサイト
【概要】
京都大学大学院理学研究科 関山直孝 助教、児玉高志 同研究員(研究当時、現:大阪大学蛋白質研研究所)、杤尾豪人 同教授、理化学研究所放射光科学研究センター 高場圭章 基礎科学特別研究員、眞木さおり 同研究員、米倉功治 グループディレクター(東北大学多元物質科学研究所 教授を併任)らの共同研究グループは、筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis)※1の発症に関わる機構として、T-cell intracellular antigen-1(TIA-1)のプリオン様ドメインに生じるアミノ酸変異が高密度な凝縮構造を形成することがその一因となっていることを解明しました。
細胞質に形成されるストレス顆粒(SGs)の主要な構成因子の一つであるTIA-1は、特定の立体構造を持たない天然変性タンパク質領域※2であるプリオン様ドメイン(PLD)を持ちます。TIA-1のPLDには、神経変性疾患の一種である筋萎縮性側索硬化症(ALS)に関するアミノ酸変異(ALS変異)が確認されていましたが、これらの変異がどのように病気を引き起こすのかはわかっていませんでした。本研究では、核磁気共鳴法(NMR: Nuclear magnetic resonance)※3や分子動力学シミュレーション※4、そして3次元電子線結晶構造解析※5を用いて、ALS変異が引き起こす微細な構造変化を明らかにしました。この成果は、TIA-1が形成する凝縮構造を標的としたALS治療薬の開発などに貢献することが期待されます。
本研究成果は、2022年9月16日(米国東部時間)に米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」に公開されました。
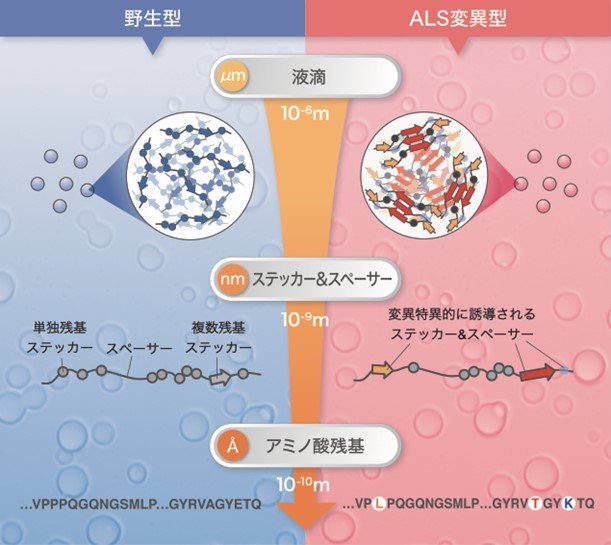
図:TIA-1の液滴形成は階層的なメカニズムで制御されており、ALS変異は周辺領域のステッカー&スペーサー骨格を変化させ高密度な凝縮構造を誘起していました。
【用語解説】
※1 筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis):
運動を司る神経(運動ニューロン)が障害を受け、筋肉が動かせなくなる病気。ALSのうち約5%は家族歴を伴い、家族性ALSと呼ばれる。TIA-1のアミノ酸変異も家族性ALSの遺伝子解析から見つかっている(Mackenzie et al. 2017 Neuron)。
※2 天然変性タンパク質領域:
一般的なタンパク質はポリペプチド鎖が折り畳まれ特定の立体構造をとるが、天然変性タンパク質領域は特定の立体構造をとらず、ランダムコイル状の不規則な立体構造をとる。
※3 核磁気共鳴法(NMR: Nuclear magnetic resonance):
強い磁場中に置かれた原子核に電磁波を照射することで起こる核スピンの共鳴現象を利用し、タンパク質分子の構造や運動性を解析する手法。
※4 分子動力学シミュレーション:
タンパク質分子を構成する原子1つ1つに対して、古典力学におけるニュートンの運動方程式を解くことで、分子の立体構造の時間変化を解析する計算機シミュレーション手法。
※5 3次元電子線結晶構造解析:
電子顕微鏡を用い、結晶に電子線を当てることで電子線回折を起こし、構造情報を得る手法。電子顕微鏡を用いるため、微小な結晶(100 nm〜1 μm程度)でも回折情報を得ることができる。
※内容および詳細(プレスリリース本文)PDFを一部修正しました(2022年10月5日)
問い合わせ先
(研究に関すること)
東北大学多元物質科学研究所
教授 米倉 功治(よねくら こうじ)
E-mail koji.yonekura.a5*tohoku.ac.jp
(*を@に置き換えてください)
(報道に関すること)
東北大学多元物質科学研究所
広報情報室
電話 022-217-5198
E-mail press.tagen*grp.tohoku.ac.jp
(*を@に置き換えてください)

![]()
![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
