2022年 | プレスリリース・研究成果
染色体分離を制御するセパレース活性制御機構の解明 -がんの染色体分離異常に着目した、新たな治療法につながる成果-
【本学研究者情報】
〇加齢医学研究所 教授 田中耕三
研究室ウェブサイト
【発表のポイント】
- セパレース活性化動態の異常を防ぐための分子メカニズムを解明しました。
- セパレースの自己切断によって、染色体分離直前のサイクリンB1によるセパレース活性制御が増強されました。
- サイクリンB1によるセパレース活性制御が弱くなると、染色体分離異常が頻発しました。
- セパレース活性動態の異常を防ぐための機構は、がんの染色体分離異常に着目した新たな治療法の標的となることが期待されます。
【概要】
がん細胞は盛んに分裂を繰り返して増殖します。その過程で、染色体分離※1の異常を頻繁に引き起こしてしまうため、染色体数が多様な細胞(異数体細胞※2といいます)が多く作り出されています。このような染色体分離の異常ががん細胞で頻発する原因については、これまでの研究で、がん細胞では染色体分離のトリガーとなるセパレース※3という酵素の活性が早期に漏洩してしまう、ということまではつきとめられていました。セパレースの活性制御機構として、セキュリンとサイクリンB1の結合による活性抑制機構があることはわかっていましたが、活性化動態の異常が生じるメカニズムを十分には説明できていませんでした。
がん研究会がん研究所・実験病理部の広田亨(ひろたとおる)部長の研究チームは、セパレースの活性化動態の異常を防ぐための機構として、サイクリンB1によるセパレース活性制御を促進する機構が存在することを発見しました。この機構によりセパレース活性の早期漏洩が防止され、染色体分離の異常が防止されていました。
本研究は、元実験病理部研究員・現宮城県立がんセンター(安田純研究所長)の進藤軌久研究員と東北大学加齢医学研究所(川島隆太研究所長)の田中耕三教授との共同研究で行われました。
本研究成果は、2022年11月29日(日本時間11月30日、午前1時)に米国科学雑誌「Cell Reports」オンライン版に掲載されました。
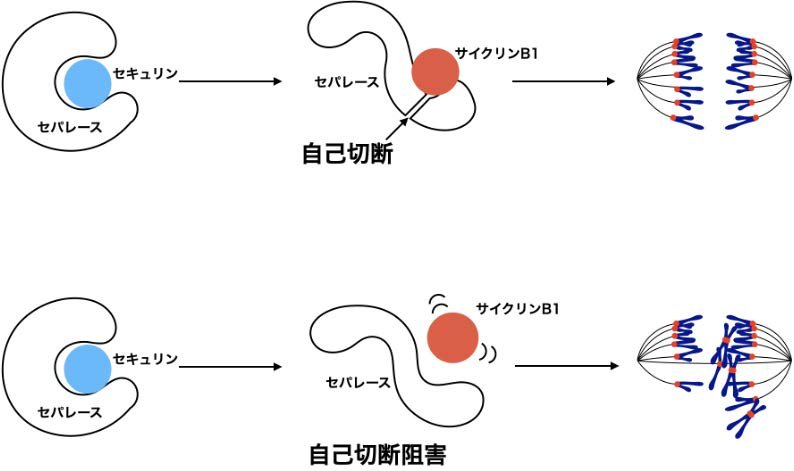
図. セパレースの自己切断を介したセパレース活性制御
【用語解説】
(※1)染色体分離
細胞の遺伝情報は染色体という構造体に含まれており、ヒトの細胞には46本の染色体があります。細胞が分裂する前にゲノム情報が複製され、92本の姉妹染色分体と呼ばれる構造体ができますが、お互いのコピーである姉妹の染色分体はすぐには分離せず、コヒーシンと呼ばれる接着因子によって繋ぎとめられています。細胞が分裂して2つの娘細胞ができるときに、このコヒーシンがセパレースと呼ばれるタンパク質分解酵素によって切断され、それぞれの染色体は均等に娘細胞に分配されます。がん細胞ではこの染色体分離過程にエラーが生じて、異数体細胞※2が作りだされています。
(※2)異数体細胞
上述のようにヒトの細胞の染色体数は46本ですが、多くのがん細胞はそこから大きく逸脱した染色体数になっています。このように染色体数が46本以外の多様な本数になっている細胞を異数体細胞と呼びます。染色体は遺伝情報を含んでいますので、その本数がバラバラということは異なる性質を持った細胞、すなわち多様性の高い細胞、が多く存在しているということになります。このようながん細胞の多様性は、がんの治療を難しくする一因となっています。
(※3)セパレース
染色体分離時、姉妹染色分体間のコヒーシンを切断するタンパク質分解酵素です。染色体分離以前には、セキュリンとサイクリンB1が結合することによってセパレース活性は抑制されています。セパレースはコヒーシン以外にもセパレース自身も切断する「自己切断」と呼ばれる活性を持っています。本研究はこの自己切断の意義の解明から発展しました。
問い合わせ先
<本研究に関すること>
東北大学加齢医学研究所・分子腫瘍学研究分野
教授 田中 耕三
TEL:022-717-8491
e-mail:kozo.tanaka.d2*tohoku.ac.jp(*を@に置き換えてください)
<報道に関すること>
東北大学加齢医学研究所 広報情報室
TEL:022-717-8443
e-mail:ida-pr-office*grp.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています