2023年 | プレスリリース・研究成果
ナノ粒子化した抗炎症薬による新たながん治療戦略 抗がん剤を使用せずに治療効果を発揮できる戦略として期待
【本学研究者情報】
〇薬学研究科 教授 秋田英万
研究室ウェブサイト
【発表のポイント】
- ナノ粒子化した抗炎症薬によって抗がん剤を使用せずとも腫瘍モデルマウスの治療を実現した。
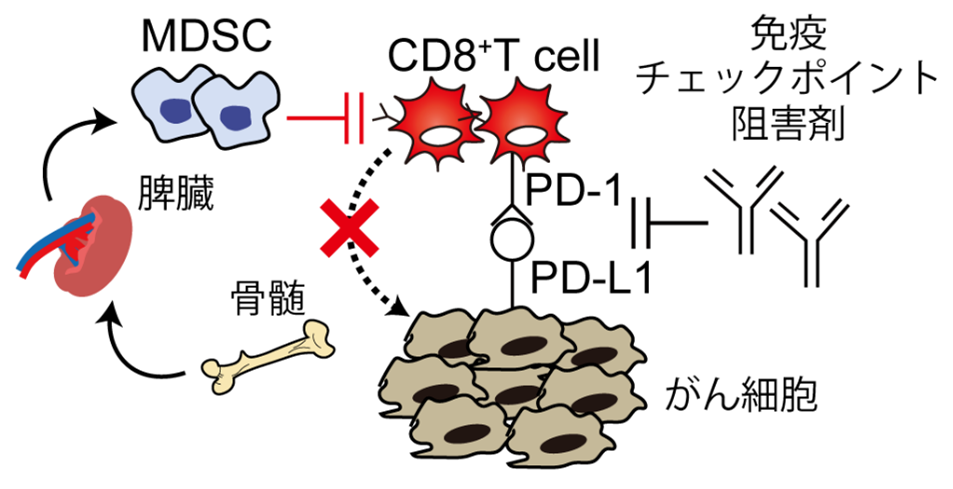
- 脾臓の炎症環境を改善することによってがんに対する免疫抑制細胞の供給を断ち切り、結果として抗腫瘍免疫を再活性化できることを発見した。
- 奏効率注1が問題視されている免疫チェックポイント阻害剤注2の治療抵抗性を克服する戦略として期待される。
【概要】
近年、がんが形成する免疫抑制性の微小環境を改善することで、宿主本来の抗腫瘍免疫が活性化され、がん治療へとつながる"がん免疫療法" が新たな治療方法として注目されています。がんの免疫抑制性の微小環境の形成に寄与する細胞の中でも、骨髄由来抑制細胞(MDSC)注3は重要な治療標的です。この細胞は骨髄で生まれ成熟の場である脾臓から血液を介して腫瘍組織に供給されることで、がん疾患の増悪や免疫チェックポイント阻害剤の治療抵抗性に関与すると報告されています。このMDSCの組織間クロストーク注4は、がんが体内に存在することで発生する慢性的な炎症によって引き起こされる可能性があると考えられています。
東北大学大学院薬学研究科の秋田英万教授、千葉大学大学院薬学研究院の田中浩揮助教、同大医学薬学府博士後期課程3年生の土井瑞貴氏、および医学薬学府博士後期課程(当時)の大東昂良博士を中心とする研究グループは、治療標的として脾臓内の炎症環境に着目し、慢性炎症の改善を介してMDSCの組織間クロストークを断ち切り、二次的に抗腫瘍免疫を正常化する戦略を考案しました。本戦略では、従来のように殺細胞効果を持った抗がん剤を用いてがん細胞自身を傷害するのではなく、抗炎症薬(デキサメタゾン)をナノ粒子に搭載し脾臓に多く存在する貪食細胞注5を標的化します。
さらに免疫チェックポイント阻害剤と併用することで、免疫チェックポイント阻害剤単体では治療抵抗性を示すがん種に対しても、本戦略との併用により高い抗腫瘍効果を発揮できます。本戦略は抗がん剤を使用せずにがん治療を実現できるだけでなく、既存の治療法の奏効率を改善する手法としても有用であると期待されます。
本成果は2023年1月27日に Small 誌電子版に掲載されました。
【用語解説】
注1 奏効率
がんに対する治療法の治療効果があらわれた割合、またはあらわれる割合。
注2 免疫チェックポイント阻害剤
細胞傷害性のT細胞やその他免疫細胞、もしくは非免疫細胞に免疫細胞の機能を抑制する免疫チェックポイント分子を阻害する抗体治療薬。
注3 骨髄由来抑制細胞(MDSC)
骨髄の未成熟な単球から分化する免疫抑制細胞の一種。細胞の形態によって顆粒球形MDSCと単球系MDSCの二種類に分類され、それぞれメカニズムが異なるものの、免疫細胞を抑制する機能を発揮する。炎症部位の骨髄や脾臓から炎症部位へと遊走され、免疫反応を制御しているが、がんにおいては、抗腫瘍免疫を担う細胞傷害性のT細胞を抑制し、がんの成長や増悪を促進する一面も持つ。
注4 MDSCの組織間クロストーク
本研究におけるクロストークとは、骨髄、脾臓、腫瘍組織におけるMDSCの遊走サイクルを意味しており、MDSCが組織間を循環することによって抗腫瘍免疫に対して全身性の抑制環境が形成される。
注5 貪食細胞
生体内に侵入した病原体や老化した細胞などを貪食し、異物や不要な細胞を排除する細胞。主に肝臓や脾臓に多く存在する。ナノ粒子製剤は主に貪食細胞に取り込まれることが多い。
問い合わせ先
(研究に関すること)
東北大学大学院薬学研究科
教授 秋田 英万 (あきた ひでたか)
電話 022-795-6831
E-mail hidetaka.akita.a4*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院薬学研究科・薬学部 総務係
電話 022-795-6801
E-mail ph-som*grp.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています