2023年 | プレスリリース・研究成果
セレノインスリンの高効率な化学合成を実現、持効性の発現も確認 ~持効型インスリン製剤開発の新たな戦略を提案~
【本学研究者情報】
〇学際科学フロンティア研究所
准教授 奥村正樹
研究室ウェブサイト
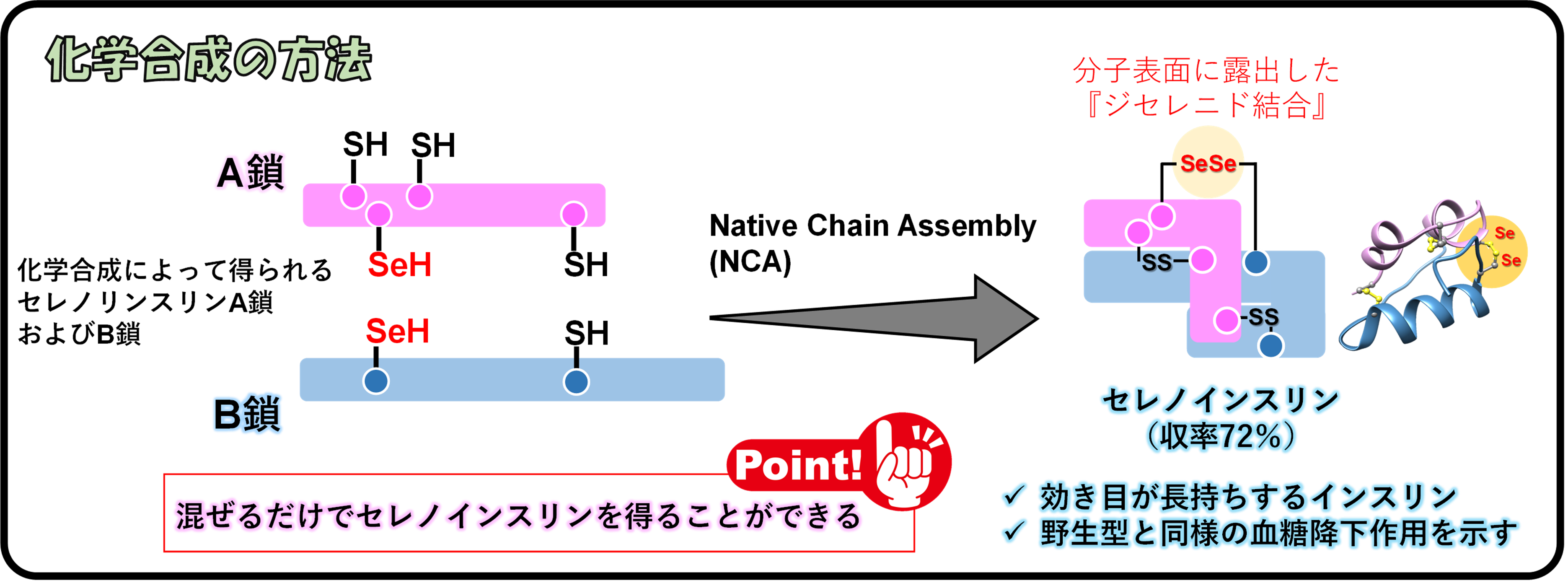
東海大学(所在地:神奈川県平塚市北金目4-1-1、学長:松前 義昭〔まつまえ よしあき〕)理学部化学科講師の荒井堅太(同大学先進生命科学研究所兼務)および同学科教授の岩岡道夫(同大学先進生命科学研究所長兼務)、東北大学(所在地:宮城県仙台市青葉区片平2-1-1、総長:大野 英男〔おおの ひでお〕)学際科学フロンティア研究所准教授の奥村正樹、多元物質科学研究所教授の稲葉謙次、大阪大学(所在地:大阪府吹田市山田丘1-1、総長:西尾 章治郎〔にしお しょうじろう〕)蛋白質研究所教授の北條裕信、韓国基礎科学支援研究院(略称KBSI)バイオ融合研究部教授の李映昊らで構成される国際共同研究グループは、インスリンを構成する2本の異なるポリペプチド鎖*1(A鎖およびB鎖)の間に形成され分子表面に露出したジスルフィド結合*2の硫黄原子をセレン原子に置換した人工インスリン(セレノインスリン*3)の化学合成を高効率化させることに成功しました。
さらに、セレノインスリンが可溶性の分子集合体を形成することでインスリン分解酵素(IDE)*4による分解を受けにくくなっていることを突き止め、セレノインスリンが通常のインスリンよりも長時間にわたって薬理効果(血糖降下作用)を発揮することを明らかにしました。本研究は、インスリンの分子表面を化学的に修飾して体内での自己組織化を促すことでインスリンに分解酵素耐性を付与するという、新たな持効型製剤の設計指針を提案するものです。
なお、本研究成果は、11月21日(火)付でイギリスの国際化学誌『Communications Chemistry』電子版に掲載されました。
【用語解説】
*1ポリペプチド鎖
構成単位であるアミノ酸がペプチド結合と呼ばれる結合で多数連なった生体高分子の総称。創薬モダリティのターゲットとしても注目されている。体内で、ある生理機能を果たしているポリペプチド鎖はタンパク質と呼ばれる。ゆえに、インスリンもタンパク質の一種。アミノ酸は主に20種類存在し、これらの連なる順番や数によってポリペプチド鎖の構造と機能が制御されている。
*2ジスルフィド結合
タンパク質の構造安定化因子の一つで、アミノ酸の一種であるシステインはチオール(SH)基という硫黄(S)を含む部位を持ち、2つのSH基が酸化することでジスルフィド結合が形成される。
*3セレノインスリン
インスリンのA鎖とB鎖の間で架橋される1対のジスルフィド結合の硫黄原子を安定性に富んだセレン(Se)原子に置き換えた人工インスリン。立体構造と生理活性が天然のインスリンと同じでありながら、インスリン分解酵素(IDE)に分解されにくい性質を持つため、体内で薬効が長時間持続する新たなインスリン製剤として糖尿病治療などへの応用が期待されている。
*4インスリン分解酵素(IDE)
腎臓や肝臓に主に分布する酵素で、健常者においては過剰分泌されたインスリンを分解する働きを持つ。
問い合わせ先
(研究に関すること)
東北大学学際科学フロンティア研究所
准教授 奥村正樹
TEL: 022-217-5628
E-mail: okmasaki*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学学際科学フロンティア研究所
企画部
特任准教授 藤原英明(ふじわら ひであき)
TEL: 022-795-5259
Email: hideaki*fris.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています