2020年 | プレスリリース・研究成果
精神疾患に関わるPAC1受容体のシグナル伝達複合体を可視化
【発表のポイント】
- 構造未知であったヒト由来PAC1受容体とGタンパク質との複合体構造を明らかにしました。
- PAC1受容体の細胞外ドメインはリガンドの効率的な受容には必要であるものの、受容体の活性化には必須でないことを明らかにしました。
- 本研究は、PAC1受容体の理解を深め、その低分子創薬に貢献するとともに、Class B GPCRにおける細胞外ドメインの役割の多様性を示すものです。
【発表概要】
GPCR(注1)は、ヒトに約800種存在する膜タンパク質であり、細胞内のGタンパク質を活性化することで細胞にシグナルを伝えます。GPCRの一種であるPAC1受容体(注 2)は中枢神経系および末梢組織に広く存在するGPCRであり、PAC1受容体選択的な内在性ペプチドPACAP(注 3)により活性化されます。PAC1受容体は摂食制御、糖代謝、精神疾患、涙液分泌などにおいて重要な役割を果たしており、有望な創薬標的として研究されてきました。しかしPAC1受容体の立体構造が未知であるため、医薬品開発が妨げられていました。
今回、東京大学大学院理学系研究科の小林和弘大学院生、志甫谷渉研究員、西澤知宏助教、濡木理教授、東北大学大学院薬学研究科の井上飛鳥准教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析(注 4)によって、PACAP、PAC1受容体およびGタンパク質からなるシグナル伝達複合体の立体構造を解明しました。複合体構造からは、PAC1受容体によるPACAPの認識機構の詳細が明らかになりました。構造とそれに基づいた機能解析によって、PAC1受容体の細胞外ドメイン(注 5)はPACAPの効率的な受容には必要である一方で、受容体の活性化には必須でないことを明らかにしました。
本研究成果は、PAC1受容体の理解を深めその医薬品開発に貢献するとともに、クラスB GPCRにおける細胞外ドメインの役割の多様性を示すものです。
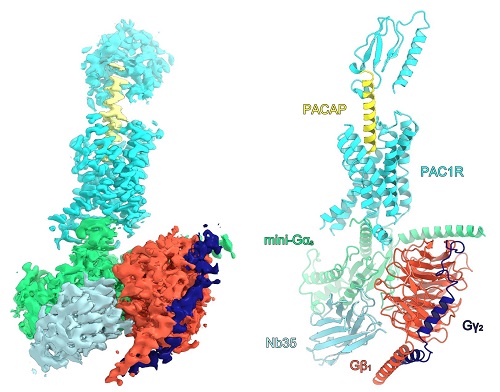
図1 PAC1受容体のシグナル伝達複合体の全体構造
左が単粒子解析によって得られた密度マップ。右が密度マップに基づいてモデリング下シグナル伝達複合体の立体構造。
【用語解説】
(注1)Gタンパク質共役受容体(GPCR):
全タンパク質において最大のファミリーを形成する7回膜貫通タンパク質。細胞外領域に特定のリガンドが結合することで活性化し、細胞内のGタンパク質を活性化することでシグナル伝達を行う。内分泌調節において主要な役割を担うことから、既承認薬の30%以上がGPCRを標的にしている。
(注2)脳下垂体後葉アデニル酸シクラーゼ1型(PAC1)受容体:
PAC1受容体はクラス B GPCRに属し、主にアデニル酸シクラーゼを活性化する刺激性Gタンパク質(Gs)を活性化する。PAC1受容体は中枢神経系および末梢組織に広く発現している3。PACAPによるPAC1受容体シグナル伝達は、概日リズム調節、摂食制御、糖代謝、学習と記憶、ニューロンの個体発生、アポトーシス、免疫系の調節など、いくつかの細胞プロセスにおいて重要な役割を果たしている。
(注3)脳下垂体後葉アデニル酸シクラーゼ活性化ペプチド(PACAP):
(PACAP)は、ヒツジ視床下部の抽出物から発見された38アミノ酸の直鎖ペプチドであり、神経栄養因子、神経保護薬、神経伝達物質、免疫調節薬、血管拡張薬として作用する多機能ペプチドホルモンである。PACAPは主に中枢神経系に分布するが、精巣、副腎、消化管、および他の末梢器官にも検出される。PACAPは血管作動性腸管ポリペプチド(VIP)と68%のアミノ酸配列相同性を有している。PACAPとVIPは3つの異なるPACAP受容体、PAC1受容体、VPAC1受容体、VPAC2受容体を異なる親和性で刺激する。これらの受容体は約50%の配列同一性を有している。PAC1受容体のPACAPに対する親和性はVIPに対する親和性よりも高く、PAC1受容体がPACAPに対して選択的であることを示している。
(注4)クライオ電子顕微鏡を用いた単粒子解析:
電子顕微鏡を用いて撮影した多数の生体高分子の像からタンパク質の立体構造を再構成することで、タンパク質などの生体高分子の立体構造を決定する手法。液体窒素(-196℃)冷却下でタンパク質などの生体分子に対して電子線を照射し、試料の観察を行う。タンパク質の立体構造を高分解能で決定する手法として、検出器などにおいて目覚ましい技術革新を遂げており、2017年に、その開発に貢献した海外の研究者三名にノーベル化学賞が贈られた。
(注5)細胞外ドメイン:
120〜160アミノ酸で構成される細胞外領域に存在するドメインであり、7回膜貫通領域に加えてクラスB GPCR全体に共通した構造である。クラスB GPCRのリガンドである長いペプチドホルモンを受容するために機能していると考えられているが、その詳細な機能はわかっていない。
※「図4:短小化ペプチドを用いた機能解析」のキャプション中における「NanoBiT G-protein」を「NanoBiT-G-protein」に修正。(3/10修正)
問い合わせ先
東北大学大学院薬学研究科総務係
E-mail:ph-som*grp.tohoku.ac.jp(*を@に置き換えてください)
TEL:022-795-6801
FAX:022-795-6805
