2021年 | プレスリリース・研究成果
肺がん治療薬イレッサの副作用を解析 イレッサが肺障害を引き起こすメカニズムを解明
【発表のポイント】
- 肺がん治療薬イレッサが炎症を惹起する仕組みを解明しました。
- イレッサがインターロイキン-1β(注1)という炎症を引き起こす物質の分泌を促進させることを発見しました。
- インターロイキン-1βの分泌を抑えると、イレッサによる肺炎が治まることを発見しました。
- 本研究成果は、イレッサによる致死性副作用の克服につながります。
【概要】
肺がん治療薬として2002年7月に承認されたイレッサは、副作用の少ない分子標的治療薬(注2)として期待されましたが、承認直後から急性肺障害や間質性肺炎(注3)などの致死性副作用が問題となりました。しかし、イレッサが肺障害を引き起こすメカニズムは不明のままでした。
東北大学大学院薬学研究科の野口拓也准教授、関口雄斗大学院生、松沢厚教授らの研究グループは、イレッサが肺障害を引き起こすメカニズムを解明しました。イレッサは免疫応答を担うマクロファージに作用し、細胞内にあるNLRP3インフラマソーム(注4)という分子複合体を活性化することで炎症を誘導し、インターロイキン-1βの分泌を促すことが明らかになりました。さらには、インターロイキン-1βの分泌を増強するHMGB1(注5)という起炎物質の分泌も促します。本研究は、インターロイキン-1βがイレッサの致死性副作用に深く関わることを示す新知見であり、イレッサによる致死性副作用の克服につながることが期待されます。
本研究の成果は、1月6日に英国科学雑誌 Cell Death and Disease に掲載されました。
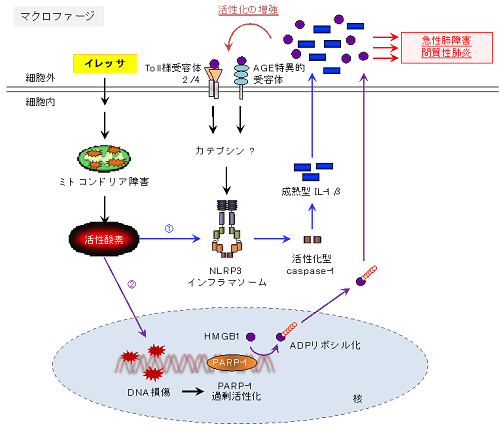
図: イレッサによる炎症誘導機構
イレッサはミトコンドリア障害を引き起こすことで活性酸素を産生させ、それがNLRP3インフラマソーム活性化の引き金となり、インターロイキン-1β(IL-1β)を産生・放出する(①)。さらにイレッサは、活性酸素で生じたDNA損傷によって過剰に活性化したPARP-1を介してHMGB1を放出する(②)。放出されたHMGB1は、Toll様受容体2/4やAGE特異的受容体を介してNLRP3インフラマソームを活性化することで、イレッサによる炎症反応を増強させる働きがある。以上のように、イレッサは異なる2つの経路を介してマクロファージを活性化し、炎症を誘導することで間質性肺炎などの致死性副作用を引き起こしていることが考えられる。
【用語解説】
(注1)インターロイキン-1β(IL-1β)
主に単球やマクロファージで産生されるタンパク質で炎症や感染防御に重要な役割を果たす。代表的な炎症性サイトカインの一種である。
(注2)分子標的治療薬
病気の原因となっている特定の分子に対してだけ作用するように設計された治療薬。
(注3)間質性肺炎
呼吸機能を担う肺胞と肺胞の間(間質)に炎症を来す肺炎の総称。
(注4)NLRP3インフラマソーム
NLRP3と呼ばれるタンパク質を核として細胞内に形成されるタンパク質複合体。病原微生物の感染や細胞内のダメージをNLRP3が感知することによって形成が促進される。形成されたNLRP3インフラマソームは、インターロイキン-1βやインターロイキン-18の分泌を促進し、炎症を誘導する。
(注5)HMGB1(High-mobility group box 1)
核内に存在し、遺伝情報の制御に寄与していると考えられているが、これとは別な機能として、細胞が感染や起炎物質にさらされると細胞の外に放出され、周囲の細胞に炎症反応を惹起する。
問い合わせ先
東北大学大学院薬学研究科
担当 松沢厚
電話 022-795-6827
E-mail atsushi.matsuzawa.c6*tohoku.ac.jp(*を@に置き換えてください)
