2021年 | プレスリリース・研究成果
細胞のタンパク質品質管理機構に関する新たな知見 ~ジスルフィド結合の形成・開裂に関わる酵素の新たな二量体形成モチーフの発見と機能制御機構の解明~
【本学研究者情報】
〇本学代表者所属・職・氏名:学際科学フロンティア研究所・助教・奥村 正樹
研究室ウェブサイト
多元物質科学研究所・教授・稲葉 謙次
研究室ウェブサイト
【発表のポイント】
- X線結晶構造解析注1およびX線小角散乱(SAXS)注2を組み合わせることで、ジスルフィド結合の形成・開裂に関わる酵素P5の、動きに富む二量体構造を決定した。
- P5の二量体形成モチーフは、これまで見つかっているロイシンジッパーなどのモチーフと似ているものの、相互作用様式は根本的に異なることを明らかにした。
- P5の二量体構造が、小胞体ストレスセンサーの構造機能制御に重要であることを明らかにした。
- P5のタンパク質凝集抑制機能はカルシウムによって制御されることを明らかにした。
- P5の二量体モチーフの欠損は小胞体ストレスを惹起するため、P5が関わる疾病の原因解明につながると期待される。
【概要】
細胞内の小胞体注3には、新しく作られたタンパク質に、構造を安定化するためにジスルフィド結合を導入する仕組みがあります。これを担っているのがPDIファミリー酵素注4です。PDIファミリー酵素の一つであるP5は、癌などの疾患や小胞体ストレス応答注5、血液凝固といった様々な生理機能と関わることが報告されていましたが、全体構造が不明なため、詳しいメカニズムは十分に理解されていませんでした。
東北大学 学際科学フロンティア研究所の奥村正樹助教、金村進吾研究員(現 関西学院大学 理工学部 助教)、松﨑元紀研究員(現 徳島大学 先端酵素学研究所 助教)、東北大学 多元物質科学研究所の稲葉謙次教授(生命科学研究科、大学院理学研究科化学専攻 兼任)、徳島大学 先端酵素学研究所の齋尾智英教授、韓国基礎科学支援研究院の李映昊教授、自然科学研究機構 分子科学研究所の秋山修志教授らの研究グループは、X線結晶構造解析およびX線小角散乱(SAXS)を組み合わせることによりP5がユニークな構造モチーフを介して二量体構造をとることを発見しました。
構造情報から二量体を形成できない変異型P5を作製したところ、P5自体の立体構造が不安定化し小胞体ストレスセンサーの制御能が低下しました。加えて、カルシウムによるP5のタンパク質凝集抑制機能(分子シャペロン注6活性)の制御が低下することも明らかとなりました。これらの結果から、P5が十分に機能を発揮するには二量体構造が重要であることが解明され、本成果は医学的にも重要な知見をもたらします。
本研究成果は、2021年4月14日16時(米国時間)に「Structure」誌のオンライン速報版で公開されました。
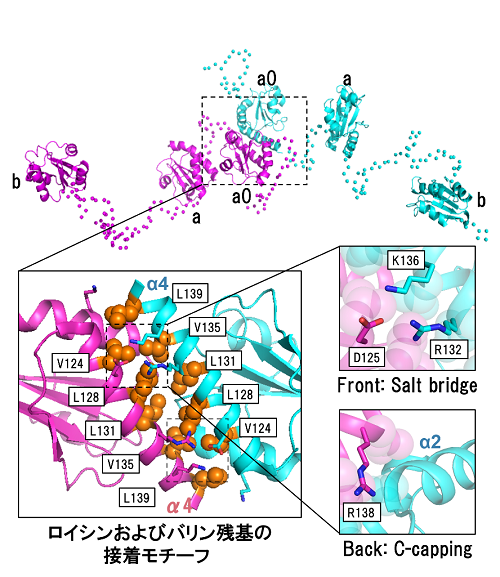
図1 P5二量体の全長構造と新規の接着モチーフ
(上図)三つのチオレドキシン様ドメイン(a0、a、b)から構成されるP5は、a0ドメイン中に存在する接着モチーフを介して二量体構造をとることがわかった。また、これら三つのドメインが可動性に富んだリンカーにより連結され、様々な配置をとることがわかった。
(下図)a0ドメイン中の接着モチーフは、五つのロイシンおよびバリン残基から構成され、これらの残基は脊椎動物を通じて非常に広く保存されていた。また、その近傍でもイオン結合などの相互作用により、二量体構造が安定化していることが示された。この接着モチーフの相互作用様式は、これまで見つかっているロイシンジッパーなどの二量体化モチーフとは大きく異なっていた。
【用語解説】
注1)X線結晶構造解析
高濃度・高純度のタンパク質を結晶化させ、強いX線を照射することで分子構造を決める方法。原子レベルで分子構造を決定することができるが、対象のタンパク質によっては結晶の作製が困難な場合もある。
注2)X線小角散乱(SAXS)
溶液中の物質に強いX線を照射した際、ナノ粒子の構造に応じてX線の散乱が変わることを利用して、観察対象粒子の慣性半径、形状、体積などの情報を得る手法。
注3)小胞体
細胞内小器官の1つ。膜タンパク質や分泌タンパク質が合成され、立体構造形成が進行する。このとき、タンパク質は糖鎖修飾やジスルフィド結合形成を受ける。
注4)PDIファミリー酵素
小胞体に存在し、ジスルフィド結合の形成、組み換え、開裂を触媒する酵素群の総称。酵素によっては、タンパク質凝集を防ぐ分子シャペロン活性を有する。哺乳細胞の小胞体には20種類以上のPDIファミリー酵素が存在するが、個々のタンパク質の生理機能や、なぜこれほど多くの酵素が必要なのかは未解明である。
注5)小胞体ストレス
小胞体内で何らかの原因により構造異常な変性タンパク質が蓄積すると、小胞体ストレスが引き起こされます。小胞体ストレスを感知するストレスセンサーとしてIRE1、PERK、 ATF6が存在し、小胞体ストレス応答(UPR:unfolded protein response)と呼ばれるいくつかのシグナル伝達経路が活性化されることにより、変性タンパク質の蓄積が低減されます。
注6)分子シャペロン
タンパク質の立体構造形成を助け、凝集を防ぐ分子の総称。「シャペロン」とはフランス語で若い女性が社交界にデビューする際の介添人を意味する。
問い合わせ先
<研究に関すること>
奥村 正樹(オクムラ マサキ)
東北大学 学際科学フロンティア研究所 助教
〒980-8578 仙台市青葉区荒巻字青葉6-3
Tel:022-795-5764
E-mail:okmasaki*tohoku.ac.jp(*を@に置き換えてください)
稲葉 謙次(イナバ ケンジ)
東北大学 多元物質科学研究所 教授
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel:022-217-5604
E-mail:kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
<報道担当>
鈴木 一行(スズキ カズユキ)
東北大学 学際科学フロンティア研究所 企画部
〒980-8578 宮城県仙台市青葉区荒巻字青葉6-3
Tel: 022-795-4353
E-mail: suzukik*fris.tohoku.ac.jp(*を@に置き換えてください)
伊藤 智恵(イトウ トモエ)
東北大学 多元物質科学研究所 広報情報室
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
