2022年 | プレスリリース・研究成果
CAMSAP2 タンパク質による中⼼体に依存しない微⼩管ネットワーク形成のしくみを解明 ― 細胞の形を作る仕組みの⼀端を解明 ―
【本学研究者情報】
〇学際科学フロンティア研究所 先端学際基幹研究部 准教授 丹羽伸介
研究室ウェブサイト
【概要】
神戸大学大学院医学研究科の仁田亮教授、今崎剛助教らの研究グループは、理化学研究所生命機能科学研究センターの竹市雅俊客員主管研究員(理研名誉研究員)、同放射光科学研究センター生物系ビームライン基盤グループ重松秀樹研究員(研究当時、現高輝度光科学研究センター構造生物学推進室研究員)、東北大学学際科学フロンティア研究所の丹羽伸介准教授らとの共同研究により、細胞の構築・極性形成※1に重要な役割を果たす微小管ネットワーク※2が、CAMSAP2タンパク質の相分離※3する性質を利用して形成されることを、クライオ電子顕微鏡※4や全反射照明蛍光顕微鏡※5を用いて明らかにしました。本研究成果は、心筋細胞、神経細胞、上皮細胞、線維芽細胞などの細胞を形づくる際に用いられる、細胞の根源的なしくみを説明するものです。この研究成果は、2022年6月28日に、国際学術雑誌「eLife」にオンライン掲載されました。
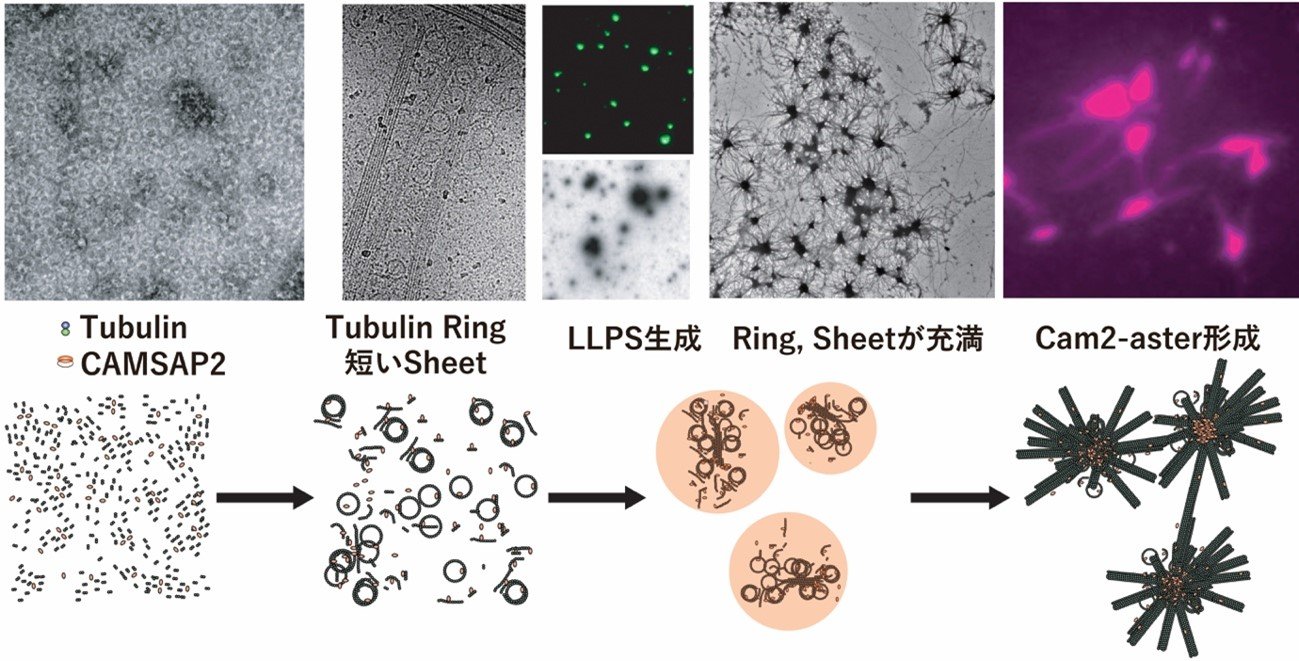
図: CAMSAP2 による微⼩管重合制御。上: 試験管内再構成系におけるCAMSAP2 による重合制御を電⼦顕微鏡、蛍光顕微鏡、全反射蛍光顕微鏡で観察した様⼦。下: CAMSAP2 による微⼩管重合・ネットワーク形成のモデル。チューブリンが縦に連なり、カールしてリング状になったチューブリンリング、チューブリン繊維がいくつか隣同⼠並んで形成されたシートが観察される。緑︓CAMSAP2、マジェンタ︓チューブリン。
【用語解説】
※1 細胞の極性︓細胞の特徴をきめる形態、構造。極性形成には、細胞⾻格分⼦であるアクチンや微⼩管が重要な役割を果たす。
※2 微⼩管ネットワーク︓微⼩管が形成する細胞の⾻組みとなるネットワーク構造で、細胞の形態形成や細胞内物質輸送のための道路としても機能しています。
※3 相分離: 2つの液体が互いに混ざり合わず、2相に分離する現象を相分離と⾔います。近年の研究により、⼀部のタンパク質は⽔の中の油のように分離して、相分離することが分かってきました。⽔溶液中でタンパク質が相分離すると、油滴のように集まって化学反応の場を形成し、特定の機能を発揮します。
※4 クライオ電⼦顕微鏡︓核酸やタンパク質などの⽣体試料を観察するために開発された電⼦顕微鏡で、クライオ電⼦顕微鏡の技術開発を⾏った3⼈の研究者は2017年度のノーベル化学賞を受賞しました。⽣体試料を含んだ溶液を薄く展開し、液体エタン(-183℃〜-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電⼦顕微鏡により観察します。試料を染⾊固定する⽅法に⽐べて、低温で電⼦線を照射するために試料の電⼦線による損傷が軽減されること、また試料を⽣理的な溶液条件で観察できること、などの利点があります。
※5 全反射照明蛍光顕微鏡︓トンネル効果によりしみ出すレバネッセント光を励起光源とした蛍光顕微鏡です。光学顕微鏡より⾼い分解能を備えるため、微⼩管や微⼩管結合タンパク質⼀分⼦の観察が可能です。
問い合わせ先
(研究に関して)
東北大学学際科学フロンティア研究所
准教授 丹羽伸介
電話: 022-795-4734
E-mail:shinsuke.niwa.c8*tohoku.ac.jp
(*を@に置き換えてください)
(報道に関して)
東北大学学際科学フロンティア研究所
特任准教授 藤原英明
電話: 022-795-5259
E-mail:hideaki*fris.tohoku.ac.jp
(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
