2023年 | プレスリリース・研究成果
プローブの凝集・解離機構を利用し、 標的エクソソームを高感度に検出 ~強い結合力と高い蛍光応答機能を発現~
【本学研究者情報】
〇大学院理学研究科化学専攻 准教授 佐藤雄介
研究室ウェブサイト
【発表のポイント】
- 長い炭素鎖(炭素数12個)を導入したシアニン色素(TRC12)をエクソソーム脂質膜結合性ペプチド(ApoC)に連結した、高感度エクソソーム(注1)検出蛍光プローブ(ApoC-TRC12)を開発しました。
- プローブが自己会合(注2)し凝集体を形成し、標的エクソソームとの結合に伴い凝集体が解消される機構により、強い結合力と高い蛍光応答機能を発現しました。
- 簡便、迅速かつ高感度なエクソソーム解析への応用が期待できます。
【概要】
エクソソームはほぼ全ての細胞が放出する細胞外小胞(直径50-150nm程度)で、細胞の恒常性維持やガンなどの疾患発症など多様な生命現象に深く関与しています。エクソソームの機能理解や医療応用に向けて、エクソソームの検出技術開発が必要不可欠です。
東北大学大学院理学研究科佐藤雄介准教授らの研究グループは、自己会合・解消機構に基づく新たなエクソソーム検出用蛍光プローブ(ApoC-TRC12)を開発することに成功しました。ApoC-TRC12単独では自己会合による凝集体形成により、その蛍光が著しく抑制されていますが、エクソソーム添加により凝集体が解消され、プローブがエクソソーム表面の脂質膜に強くかつ選択的に結合することで、明瞭な発蛍光応答を示します。ApoC-TRC12は標的エクソソームと混ぜて蛍光測定するだけという簡便な操作で迅速に高感度検出(検出限界~103個/L)が可能です。抗体を用いた既存のエクソソーム検出法では、検出原理上、解析対象は抗体が結合するマーカータンパク質が発現している種類のエクソソームに限定されますが、これに対して本プローブはエクソソーム脂質膜を結合場とするため、表面のタンパク質発現プロファイルに影響を受けず、様々な細胞由来のエクソソームの解析に適用できます。今後、本研究成果はエクソソーム研究の基礎と応用を推進する基盤技術の開拓に貢献するものと期待されます。
本研究成果は、2023年1月25日(米国東部時間)にアメリカ化学会(ACS)が出版する「ACS Sensors」誌に掲載されました。
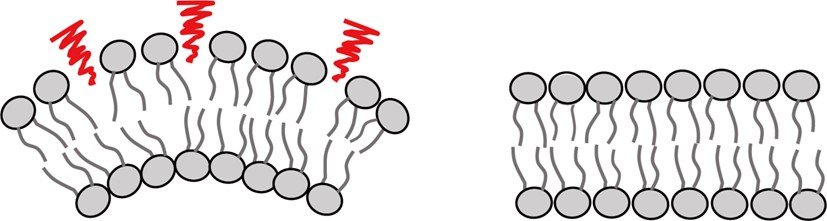
図1: 曲率の大きい膜(左)は曲率の小さい膜(右)と比べて脂質パッキング欠損(赤)が多く現れる
【用語解説】
(注1)エクソソーム
細胞から放出される小胞(直径50-150nm)。表面は膜タンパク質を含む脂質二重膜構造を取っており、核酸やタンパク質など生理活性物質を内包している。
(注2)自己会合
分子同士が疎水性相互作用や水素結合などの分子間相互作用を介して自発的に会合し凝集体を形成する。
問い合わせ先
<研究に関すること>
東北大学大学院理学研究科化学専攻
准教授 佐藤 雄介(さとう ゆうすけ)
電話:022-795-6551
E-mail:yusuke.sato.a7*tohoku.ac.jp(*を@に置き換えてください)
<報道に関すること>
東北大学大学院理学研究科
広報・アウトリーチ支援室
電話: 022-795-6708
E-mail:sci-pr*mail.sci.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
