2023年 | プレスリリース・研究成果
クライオ電顕により電荷、水素原子、化学結合を可視化 -タンパク質の詳細な化学特性の理解から、創薬への貢献に期待-
【本学研究者情報】
〇多元物質科学研究所 教授 米倉功治
研究室ウェブサイト
【概要】
理化学研究所(理研)放射光科学研究センター利用システム開発研究部門SACLAビームライン基盤グループイメージング開発チームの眞木さおり研究員、利用技術開拓研究部門生体機構研究グループの川上恵典研究員、米倉功治グループディレクター(東北大学多元物質科学研究所教授)、高場圭章基礎科学特別研究員、濵口祐研究員(研究当時)の研究チームは、クライオ電子顕微鏡[1]を用いた単粒子解析[2]から、タンパク質中のほとんどの水素原子の可視化と、電荷・化学結合に関わる情報の取得に成功しました。
本研究成果は、生理的な環境に近い水溶液中のタンパク質の機能を決定する詳細な構造特性が観察可能なことを示すもので、今後、タンパク質の化学的性質・機能の理解を深め、生命科学や医学、創薬に貢献すると期待できます。
タンパク質中の水素原子、電荷、化学結合の極性[3]は、構造の安定化に重要な役割を果たすとともに、酵素触媒作用、エネルギー伝達、基質や薬剤との結合など、さまざまな機能と性質に大きな影響を及ぼします。
[4]で明らかにしました。最も軽い原子である水素原子からの信号は弱く、可視化が難しいことが知られていますが、解析を工夫した結果、タンパク質の安定部位にあるほぼ全ての水素原子と、負に帯電したアミノ酸の電荷を可視化することに成功しました。また、得られた構造は、水素原子の結合距離からその化学結合の種類を判別できる精度を持つことも示しました。>
本研究は、オンライン科学雑誌『Communications Chemistry』(5月31日付:日本時間5月31日)に掲載されました。
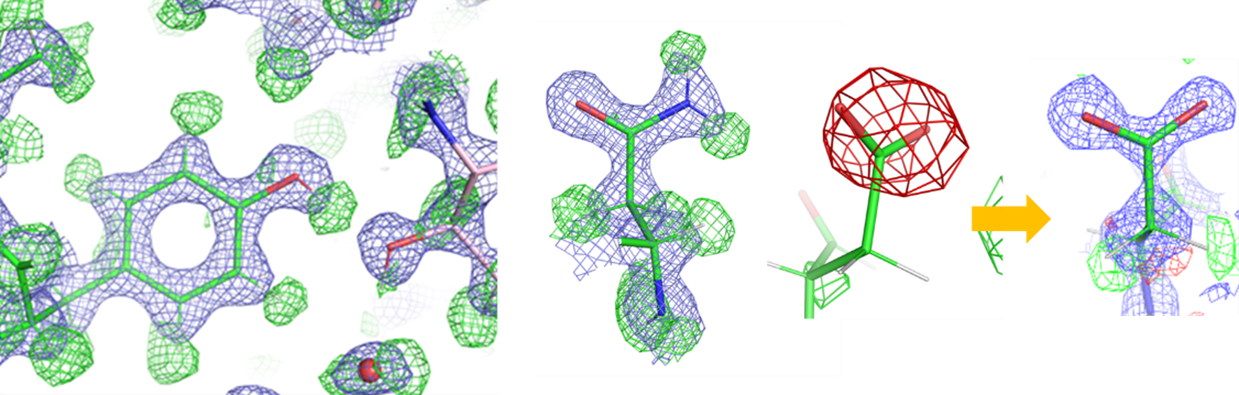
タンパク質中のアミノ酸の詳細構造(緑の網目は水素原子、赤の網目は負電荷に対応)
【用語解説】
[1] クライオ電子顕微鏡
タンパク質などの生体分子を水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料を氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。
[2] 単粒子解析
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。クライオ電子顕微鏡の技術進歩により、結晶を作らなくても分子の詳細な構造が得られるようになったことから急速に普及した。この発展を受け、クライオ電子顕微鏡の基礎技術の開発に貢献した3名のパイオニアに2017年のノーベル化学賞が贈られた。
[3] 化学結合の極性
化学結合した原子の電荷分布に偏りがあること、あるいはその偏りのこと。偏りがない場合は非極性という。
[4] 空間分解能、分解能
どのくらい細かくものを「見る」ことができるかの指標。空間分解能の値が小さい(分解能が高い)ほど、物質をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、個々の原子の解像には1Å程度の空間分解能が必要である。
問い合わせ先
(研究に関すること)
東北大学 多元物質科学研究所
教授 米倉 功治(よねくら こうじ)
電話: 022-217-5380
E-mail:koji.yonekura.a5*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)

![]()
![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
