2024年 | プレスリリース・研究成果
細胞内シグナルを操る人工受容体タンパク質の開発 - Gα12/13シグナル経路を標的とした創薬開発の効率化に貢献 -
【本学研究者情報】
〇大学院薬学研究科 分子細胞生化学分野
教授 井上飛鳥
研究室ウェブサイト
【発表のポイント】
- Gα12シグナルとGα13シグナル(注1)(総称してGα12/13シグナル)はGタンパク質共役受容体(GPCR)(注2)の情報伝達経路であり、これらを操作する技術は限られていました。
- 本研究において、Gα12/13シグナルを薬剤により誘導できるデザイナー受容体を開発しました。
- 今後、このデザイナー受容体を遺伝子導入した動物を用いることで、Gα12/13シグナル作動薬の薬理作用を効率的に探索・検証することができます。
【概要】
Gタンパク質共役受容体(GPCR)は細胞外の特定の代謝物の結合し、細胞内に情報伝達(シグナル)を誘起します。この作用により、環境変化を感知して細胞の振る舞いを環境に適応させることができます。GPCRは多様な生命現象に関わることから、創薬開発の重要な標的でもあり、現在使用されている薬の約30%はGPCRに直接作用して薬効を発揮します。
東北大学大学院薬学研究科の辰己茉菜絵大学院生(当時)、井上飛鳥教授らの研究グループは、人工的にデザインされたGPCRであるデザイナー受容体(以下、DREADD(注3))に改変を加えることで、Gα12シグナル選択型からGα12とGα13の双方を誘導するGα12/13シグナル型のDREADDを開発しました。Gα13シグナルは血管形成や免疫応答において重要な機能が知られており、Gα13シグナルを阻害または誘導することで、これらの現象が関与する疾患の治療につながる可能性があります。今後、本研究で開発したGα12/13シグナル型のDREADDを細胞やマウスに遺伝子導入し、デザイナーリガンド(注4)を投与することで誘導されるGα12/13シグナルによる細胞応答や薬理効果を調べることで、Gα12/13シグナルの疾患治療効果を判定することに役立ちます。
本研究の成果は、2024年5月15日に科学誌Scientific Reportsに掲載されました。
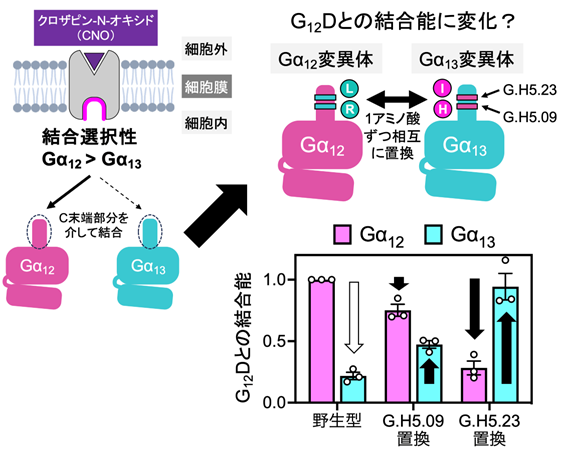
図1. G12Dとの結合に重要なGα12のアミノ酸残基の同定
Gα12-DREADD(G12D)は、Gα12に強く結合する一方で、Gα13との結合は弱い。そこで、Gα12およびGα13のGPCRとの主要な相互作用部位であるC末端部分(通称α5ヘリックス、26アミノ酸からなる)について相互置換の変異体を作製した。Gα12とGα13のC末端部位では異なるアミノ酸が8カ所あることから、計16種の変異体とG12Dの結合をTGFα切断アッセイによって評価した。その結果、G.H5.09のポジションを入れ替えた変異体(Gα12ではヒスチジン(H)をアルギニン(R)に、Gα13ではその逆に置換させた)において、Gα12変異体ではG12Dとの結合が減弱し、Gα13変異体ではG12Dとの結合が増強した。さらに、G.H5.23のポジションの変異体(Gα12ではイソロイシン(I)をロイシン(L)に、Gα13ではその逆に置換させた)では、それぞれの変異体でG12Dとの結合の強度が完全に入れ替わった。また、他の6カ所の変異体はこのようなパターンを示さなかった。この結果から、G12Dとの結合の選択性に関わるGα12とGα13のアミノ酸残基の位置を同定することができた。
【用語解説】
注1. Gα13シグナル
GPCRと結合するGαサブユニットのうち、G12ファミリーに属するGα13が介在する細胞内シグナル。Rho-ROCK経路を活性化する他、多様なシグナル分子と結合することが知られている。ノックアウトマウスによる研究から、Gα13は血管形成や免疫応答に重要な役割を担うことがわかっており、さらに様々ながん細胞種において発現の増減がみられるなど、創薬標的となり得る。
注2. Gタンパク質共役受容体(G-protein-coupled receptor、GPCR)
細胞表面の細胞膜(形質膜)に発現する受容体であり、細胞膜を7回貫通する特徴的な構造を有する。ヒトには約800種のGPCRが存在し、それぞれが特定のホルモンや代謝物などと結合する。この結合により、GPCRが活性化型へと構造変化し、細胞内のシグナル分子(主にヘテロ三量体Gタンパク質のうちのGαサブユニット)と結合することによって、さまざまな細胞応答を引き起こす。
注3. DREADD(Designer Receptors Exclusively Activated by Designer Drugsの略語)
リガンド結合部位にアミノ酸変異を導入し、特定の薬剤のみに応答するように改変した人工受容体(別名、デザイナーGPCR)。汎用されているDREADDはムスカリン性アセチルコリン受容体に由来し、内因性代謝物のアセチルコリンには応答せず、元来生物活性を有さない特定のデザイナー化合物により活性型となり、シグナル伝達を誘起する。
注4. デザイナーリガンド
DREADDを活性化させるリガンド分子。デザイナーリガンドはDREADD以外のタンパク質には結合せず、生物活性を示さない。本研究では、ムスカリン性アセチルコリン受容体由来のDREADDに対するデザイナーリガンドとして汎用されるクロザピンN-オキシド(CNO)を使用した。
問い合わせ先
(研究に関すること)
東北大学大学院薬学研究科
教授 井上 飛鳥(いのうえ あすか)
TEL: 022-795-6861
Email: iaska*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院薬学研究科・薬学部 総務係
TEL: 022-795-6801
Email: ph-som*grp.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
