2018年 | プレスリリース・研究成果
ヒト消化酵素が作られる仕組み-消化酵素が正しい構造に折り畳まれる過程に必要な因子を発見-
【要点】
- 膵臓が生産する消化酵素の一つであるエラスターゼが正しい立体構造に折り畳まれるためにはPDIpと呼ばれるタンパク質が必要であることが分かった。
- PDIpは膵臓で特異的に発現しているPDIファミリー酵素としてこれまで知られていたが、その役割については不明だった。本研究ではその役割を初めて明らかにした。
- PDIpはエラスターゼ以外にもキモトリプシン、トリプシン、α-アミラーゼなどと膵臓内で相互作用することが分かった。よって、PDIpは様々な消化酵素の生合成に働く可能性がある。
【概要】
東北大学多元物質科学研究所の門倉広准教授、藤本拓志(東北大学大学院生命科学研究科博士後期課程在学)、稲葉謙次教授、奈良先端科学技術大学院大学 研究推進機構の河野憲二特任教授、九州大学生体防御医学研究所の松本雅記准教授らのグループは、膵臓で作られる消化酵素のうちのエラスターゼと呼ばれるタンパク質分解酵素が正しい立体構造に折り畳まれる過程で必要な新規の因子PDIpを発見しました。ヒト由来の細胞中でエラスターゼを発現すると、エラスターゼは細胞内で凝集体(不溶性の塊)を形成し、正しい構造をとることができませんでした。ところが、PDIpとエラスターゼを細胞の中で同時に発現させると正しい立体構造のエラスターゼをつくることができました。即ち、PDIpは消化酵素の一つであるエラスターゼの立体構造が折り畳まれる過程で重要な役割を果たすことが分かりました。マウスの膵臓を調べたところ、PDIpは、エラスターゼ以外にも、トリプシン、キモトリプシン、α-アミラーゼなど膵臓で作られる様々な消化酵素に作用することが分かりました。よって、これらの消化酵素が正しい立体構造に折り畳まれる過程でもPDIpは働いている可能性があります。本研究から得られる知見は、将来的には、膵臓に関連する病気の原因の解明やヒト由来の消化酵素を微生物や動物細胞の培養によって生産させる際に役立つと期待されます。
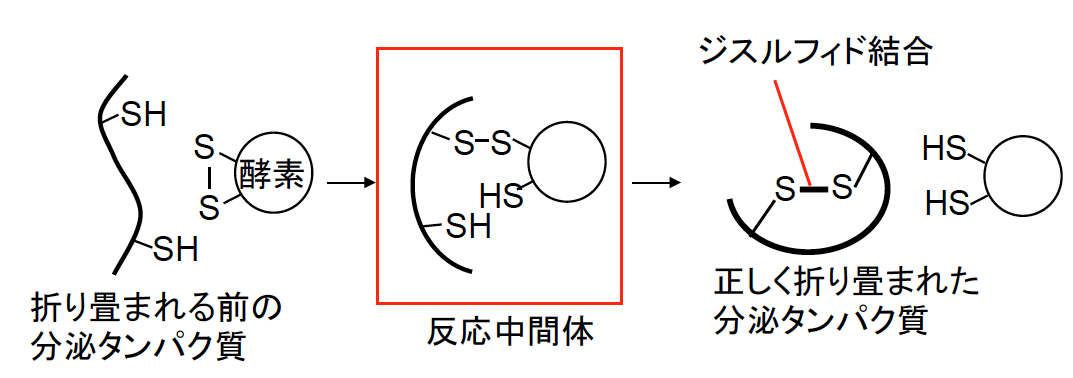
図1 PDI ファミリー酵素による分泌タンパク質の折り畳み反応の促進
折り畳み反応の途上で、PDIファミリー酵素と分泌タンパク質は分子間のジスルフィド結合でつながった反応中間体を形成する。このことを利用してPDIpが相互作用するタンパク質を膵臓から網羅的に同定した
問い合わせ先
(研究に関すること)
東北大学 多元物質科学研究所
准教授 門倉 広 (かどくら ひろし)
Tel: 022-217-5605 E-mail: hiroshi.kadokura.b3*tohoku.ac.jp (*を@に置き換えてください)
教授 稲葉 謙次 (いなば けんじ)
Tel: 022-217-5604 E-mail: kinaba*tagen.tohoku.ac.jp (*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198 E-mail:press.tagen*grp.tohoku.ac.jp (*を@に置き換えてください)
