2020年 | プレスリリース・研究成果
抗体が糖ペプチドと結合する立体構造を明らかに ―生命科学で重要となる糖鎖構造の解明へ前進―
生体内で抗体は、体内に侵入した病原性のウイルスや細菌、アレルギー物質といった抗原に対して様々な防御反応を起こします。一方で抗体は、構造や働きを明らかにしたい目的の分子に対して任意に作製でき、生命機能や疾病原因の理解のうえで重要なツールとなります。千葉大学大学院理学研究院(分子キラリティー研究センター兼任)の小笠原諭特任准教授、村田武士教授らは、東北大学未来科学技術共同研究センター/大学院医学系研究科の加藤幸成教授の研究グループ、医化学創薬株式会社との共同で、糖ペプチド注1)が結合した状態のモノクローナル抗体注2)の立体構造を原子レベルで明らかにしました。
本研究は、抗体の糖ペプチド結合部位を初めて明らかにしただけでなく、IgG抗体注3)は他の低分子型の結合分子と比較して、糖ペプチドのような大きく立体的なエピトープ(抗原認識部位)として認識できる優位性を示しています。
本研究成果は、2020年9月10日に英国科学雑誌「Biochemical and Biophysical Research Communications」にオンラインで公開されました。
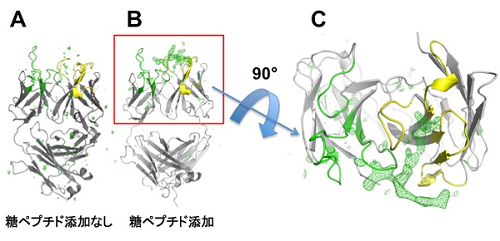
図1:本研究にて解析した、抗体と糖ペプチドの結合部分の立体構造
抗体中の抗原認識に重要な役割を担う相補性決定領域(重鎖(黄色)と軽鎖(緑))について、糖ペプチドを添加しないもの(A)と、添加したもの (B、およびC) の構造を比較した。糖ペプチド添加の構造にのみ緑色の網掛けで示す部分が観察され、糖ペプチドがこのような形で結合していることが示唆された。
【用語解説】
注1)糖ペプチド
数〜十数個のアミノ酸(ペプチド)と、アミノ酸に結合した糖鎖分子からなる物質。化学的合成法と酵素学的合成法を組み合わせて合成する。
注2)モノクローナル抗体
1種類の細胞から生成される抗体。単一の抗原を標的にするという性質から、バイオマーカーとして有用とされてきたが、近年は研究のツールとしての役割を超え、最先端の医療において重要な医薬品としても期待される。2018年に京都大学の本庶佑氏がノーベル医学・生理学賞を受賞した抗PD-1抗体に代表されるがん免疫療法などが知られる。
注3)IgG抗体
免疫グロブリンG(Immunoglobulin G)抗体の略称。免疫グロブリンには、IgG、IgA、IgM、IgD、IgEの5種類あるが、IgGが血液中に最も多く含まれ、細菌や毒素と主に結合して生体の防御反応を担う。IgG抗体はY字型をしており、重鎖(50kDa)、軽鎖(25kDa)が2つずつで構成されている。
問い合わせ先
<研究内容のお問い合わせ>
東北大学未来科学技術共同研究センター / 東北大学大学院医学系研究科抗体創薬研究分野
教授 加藤幸成
E-mail : yukinarikato*med.tohoku.ac.jp(*を@に置き換えてください)
<報道関係のお問い合わせ>
東北大学大学院医学系研究科・医学部広報室
電話番号:022-717-7891
FAX番号:022-717-8187
E-mail : pr-office*med.tohoku.ac.jp(*を@に置き換えてください)
