2026年 | プレスリリース・研究成果
深層学習によりタンパク質周辺の水和解析を実用速度に ―創薬への応用を目指し、従来法の計算時間を大幅に短縮―
【本学研究者情報】
〇大学院工学研究科応用物理学専攻 准教授 吉留崇
研究室ウェブサイト
【発表のポイント】
- 創薬において重要なタンパク質周囲の水分子の自由エネルギー分布を高速に計算する、深層学習を用いた新しい解析手法"Deep GIST"を開発しました。
- 薬剤候補のリガンド(注1)結合部位における水分子の自由エネルギー変化の計算において、従来法と良好な相関を示し、水分子の挙動を高速かつ実用的な精度で予測できることを確認しました。
- 創薬において重要な指標である「水分子の置換自由エネルギー」の効率的な評価手法として、薬剤設計への応用が期待されます。
【概要】
タンパク質は水中でのみ正しい立体構造を保ち、生命現象に不可欠な機能を発現します。タンパク質の結合部位における水分子の振る舞いを理解することは、創薬研究において重要な役割を果たします。従来法のGIST(注2)やWaterMap法は強力な解析手法ですが、計算コストが大きいという課題がありました。
東北大学大学院工学研究科の福島悠朔大学院生(研究当時)と吉留崇准教授は、深層学習を用いることで、これまでGISTで数時間〜数十時間を要していた計算を数十秒で実行できるDeep GISTを開発しました。Deep GISTを用いて、リガンド結合部位の水分子をタンパク質外に移動させるのに必要な自由エネルギー変化を計算したところ、従来法と良好な相関を示し、水分子の挙動を高速かつ実用的な精度で予測できることが確認されました。本手法により、創薬において重要な指標である「水分子の置換自由エネルギー」を効率的に評価できるようになり、薬剤候補の設計や最適化への貢献が期待されます。
本成果は2026年1月23日付けでJournal of Chemical Information and Modelingにオンライン掲載されました。
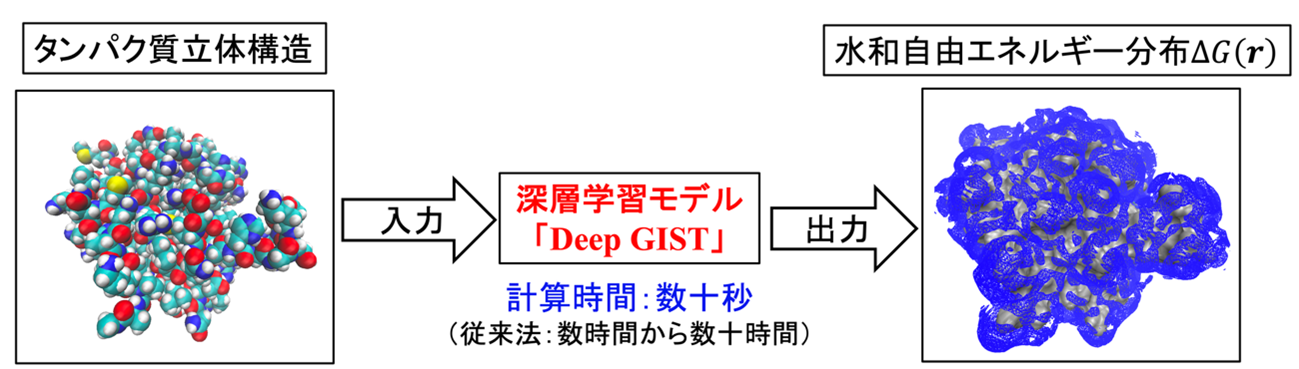
図1. Deep GISTの概要。タンパク質の立体構造を入力すると、その周囲の水和自由エネルギー分布(青色部分)を深層学習モデルにより高速に予測・出力する。
【用語解説】
注1. リガンド
タンパク質に結合する分子で、創薬では薬になる可能性のある分子(薬剤候補)がこれにあたる。リガンドがタンパク質に結合することで、その働きを弱めたり強めたりすることができる。
注2. GIST
Grid-Based Inhomogeneous Solvation Theory。タンパク質の周囲に存在する水分子の性質を、空間的な分布として解析する計算手法。タンパク質の周りを細かく区切り、水分子が安定に存在しやすい場所や、結合に影響を与える水分子の位置を調べることができ、タンパク質の基礎研究や創薬研究などで活用されている。
【論文情報】
タイトル:Deep GIST: Deep Learning Models for Predicting the Distribution of Hydration Thermodynamics around Proteins
著者:福島 悠朔 東北大学大学院工学研究科 応用物理学専攻 大学院生(研究当時)
吉留 崇* 東北大学大学院工学研究科 応用物理学専攻 准教授
*責任著者
掲載誌:Journal of Chemical Information and Modeling
DOI:10.1021/acs.jcim.5c02389
問い合わせ先
(研究に関すること)
東北大学大学院工学研究科
准教授 吉留 崇
TEL:022-795-7955
Email: takashi.yoshidome.b1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院工学研究科・工学部 情報広報室
担当 沼澤 みどり
TEL: 022-795-5898
Email: eng-pr*grp.tohoku.ac.jp(*を@に置き換えてください)

![]()
東北大学は持続可能な開発目標(SDGs)を支援しています
